Salud
Seguridad en el tratamiento de pacientes VIH+: Análisis farmacogenético de HLA-B*57:01
El estudio del gen HLA-B*57:01 es una herramienta útil que brinda una mayor seguridad en el tratamiento con Abacavir a personas viviendo con VIH en Mendoza.
Publicada el 11 DE FEBRERO 2019
Introducción
La farmacogenética es la rama de la medicina que estudia los factores genéticos responsables de la variabilidad de respuesta y la eficacia de los medicamentos en cada individuo.
El Abacavir es un fármaco utilizado en el tratamiento de la infección por el virus de la Inmunodeficiencia Humana (VIH) en combinación con otros agentes antirretrovirales como parte del tratamiento de alta eficacia contra el VIH.
Aproximadamente 5% a 8% de los pacientes infectados con el VIH tratados con Abacavir desarrollan una reacción de hipersensibilidad (RHS) que usualmente ocurre dentro de las 6 primeras semanas de terapia.
Desde el año 2002, se ha reportado una fuerte asociación entre la RHS al Abacavir y el alelo HLA-B*5701. A partir de estos hallazgos, se ha demostrado la utilidad del análisis de HLA-B*57:01 para detectar la presencia de este gen como test farmacogenético para predecir el riesgo de desarrollar RHS debida al Abacavir. Esto ha permitido disminuir drásticamente la RHS en pacientes tratados con este medicamento.
¿Qué es el HLA?
El sistema HLA (Human Leucocyte Antigens) es un conjunto de proteínas que se expresan en la superficie de las células de nuestro organismo y se encargan de presentar fragmentos cortos de proteínas (péptidos) a las células inmunológicas, más precisamente a los linfocitos T. Esos péptidos pueden provenir de proteínas propias del individuo que, normalmente, no generan respuesta inmunológica, o de bacterias, virus, parásitos, vacunas y tumores. En estos casos, sí serán reconocidos y se montarán respuestas inmunes celulares y humorales para defender al organismo del ataque de patógenos o tumores.
El sistema HLA o Complejo Mayor de Histocompatibilidad también es el principal responsable de la reacción de rechazo en los trasplante de órganos y tejidos. Este efecto se produce por la gran variabilidad o polimorfismo que presenta este sistema. Además, el modo de herencia y su forma de expresión colaboran en aumentar esta variabilidad. Las moléculas HLA se expresan en forma codominante y en haplotipos. Esto significa que todas las moléculas que vienen codificadas en nuestro ADN y que se heredan en un 50% desde la madre y otro 50% del padre, se expresarán en nuestros tejidos. Esto implica que cada persona expresa 2 proteínas HLA-A, 2 HLA-B, 2 HLA-C, 2 HLA-DR, 2 HLA-DQ y 2 HLA-DP (Figura 1). Si se tiene en cuenta la cantidad de variantes existente (por ejemplo, más de 2900 alelos HLA-A, 3700 alelos HLA-B, 2600 alelos HLA-C y 1800 alelos HLA-DR) y la combinación que ocurre en cada individuo por el modo de herencia, se puede apreciar la gran variabilidad que se produce entre distintos individuos y entre poblaciones. Esta variabilidad dificulta la compatibilidad en los trasplantes. Actualmente, la combinación de una buena compatibilidad HLA y tratamientos con drogas inmunosupresoras hacen que los trasplantes tengan éxito y salven un gran número de vidas.
Figura 1. Localización cromosómica de los genes HLA en el brazo corto del cromosoma 6
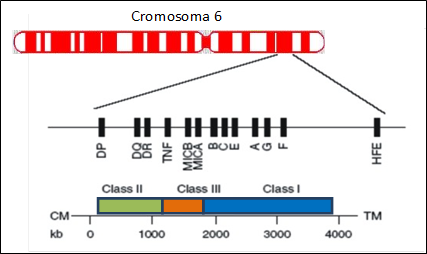
Fuente: Elaborado por las autoras
HLA y reacciones de hipersensibilidad
El HLA también está implicado en predisposición a ciertas enfermedades, sobre todo de tipo autoinmune y a reacciones de hipersensibilidad a medicamentos debido a que en esta región están contenidos genes muy variables asociados con la función inmunológica.
La hipersensibilidad es aquella respuesta inmunológica exagerada o exacerbada a un agente (inmunógeno), que se presenta tras la exposición a un estímulo en dosis que son toleradas por las demás personas.
En raras ocasiones, algunos fármacos son capaces de producir reacciones de hipersensibilidad mediadas por el sistema inmune a través de interacciones con moléculas HLA, aunque el mecanismo exacto de estas interacciones aún no está claro. Una teoría sugiere que estos compuestos podrían interactuar directamente con las moléculas HLA o receptores en células T, lo que conduce a la activación de las mismas. Un ejemplo de ello es el Abacavir, fármaco carboxílico sintético, aprobado por la Food and Drug Administration (FDA) de EEUU en 1998. El Abacavir es un potente antirretroviral inhibidor de la transcriptasa reversa viral análogo de nucleósido (ITIAN) que se prescribe junto con otros fármacos para el tratamiento de la infección por VIH tanto en niños como en adultos. Actúa al ser transformado intracelularmente en trifosfato de carbovir (análogo de la desoxiguanosina-5’-trifosfato (dGTP)), el auténtico metabolito activo, inhibiendo la transcriptasa reversa a través de un doble mecanismo, compitiendo con la dGTP e incorporándose al ADN viral, produciéndose la detención de la síntesis de ADN viral por la célula (Figura 2).
Figura 2. Metabolismo del Abacavir por enzimas celulares y su mecanismo de acción: Inhibición de la enzima transcriptasa reversa viral y freno de la replicación del VIH.
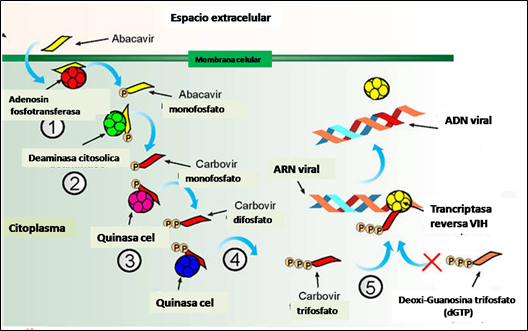
Fuente: Adaptado de http://www.immunopaedia.org.za
El Abacavir es generalmente bien tolerado, el efecto adverso más característico y grave es una reacción de hipersensibilidad (RHS) que aparece aproximadamente en 5-8% de pacientes durante las primeras 6 semanas de tratamiento, si no se realiza la preselección genética. Los síntomas de la RHS aumentan en severidad con el tiempo si el fármaco se continúa administrando. La sospecha de una RHS requiere la suspensión inmediata y definitiva del Abacavir.
La RHS suele manifestarse como un síndrome multiorgánico con una erupción cutánea eritematosa que generalmente aparece en las seis primeras semanas de tratamiento, aunque puede hacerlo más tardíamente, asociada a síntomas más inespecíficos como fiebre, náuseas, vómitos, malestar, diarrea, mialgias o artralgias. Las pruebas de laboratorio realizadas a pacientes que experimentan una RHS al medicamento, reportan alteraciones que incluyen disminución de linfocitos en sangre (linfopenia) y aumento en las enzimas hepáticas. Existe una clara predisposición genética para la RHS a Abacavir, asociada principalmente a la molécula HLA-B*57:01, presentándola más de la mitad de los pacientes con este alelo y siendo excepcional en pacientes sin el mismo. En algunos individuos, se forma un metabolito químicamente reactivo que se detoxifica inadecuadamente, llevando a la activación del sistema inmune y finalmente a un daño celular.
La incidencia de la RHS se asocia con el origen étnico entre los pacientes expuestos a Abacavir. Estudios retrospectivos y prospectivos muestran un aumento significativo del riesgo de RHS en pacientes portadores de HLA-B*57:01. Este alelo HLA tiene una predominancia en población caucásica respecto a otras etnias y su frecuencia es muy baja en asiáticos y africanos.
Los estudios inmunológicos indican que el Abacavir interactúa específicamente con HLA-B*57:01 y cambia la especificidad de unión entre la molécula HLA y el péptido endógeno, dando lugar a una reacción autoinmune sistémica que se manifiesta como síndrome de hipersensibilidad. (Figura 3)
Figura 3. a) Presentación de péptidos antigénicos restringida por HLA-B*57:01
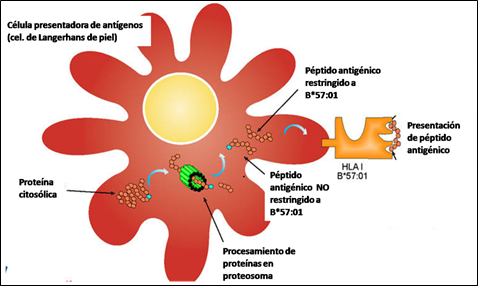
Fuente: Adaptado de http://www.immunopaedia.org.za
FIgura 3. b) Reacción inmune de hipersensibilidad a Abacavir: presentación antigénica anormal.
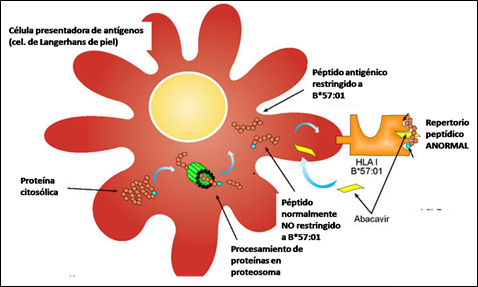
Fuente: Adaptado de http://www.immunopaedia.org.za
En el año 2002, Mallal y col. genotipificaron 200 pacientes caucásicos expuestos a Abacavir y encontraron que 18 de ellos desarrollaron hipersensibilidad al medicamento; de estos, 14 tenían el alelo HLA-B*57:01. Se demostró que era posible predecir en que pacientes era más probable que se presentara hipersensibilidad a Abacavir y sugirieron la utilidad clínica de la determinación para prevenir estas reacciones.
La FDA y las directrices internacionales de tratamiento del VIH recomiendan una rutina de screening para HLA-B*57:01 previo al tratamiento con Abacavir para disminuir el diagnóstico de falsos positivos y prevenir la RHS inducida por Abacavir. Los estudios de RHS inducida por Abacavir y la aplicación del screening HLA-B*57:01 en la clínica representa un ejemplo de éxito en la utilización de la farmacogenética para diagnóstico personalizado y terapia.
La FDA aprobó en 2008 una importante etiqueta de seguridad actualizada para el Abacavir que recomienda que los pacientes se realicen un screening para el alelo HLA-B*57:01 antes de iniciar la terapia.
La comprensión de los mecanismos inmunológicos de las reacciones inducidas por fármacos es importante por varias razones: puede ayudar a predecir qué individuos corren el riesgo de desarrollar estas reacciones y diseñar mejores fármacos que no se unan a alelos HLA de alto riesgo, para que en última instancia mejoren la eficacia y la seguridad de medicamentos prescritos en el futuro.
Investigación en población portadora de VIH de Mendoza
El objetivo de este trabajo fue determinar la prevalencia del alelo HLA-B⃰ 57:01 en población infectada con VIH de la provincia de Mendoza, comparar dicha frecuencia con las de otras poblaciones y evaluar su utilidad como test farmacogenético en la prevención de los efectos colaterales del tratamiento con Abacavir.
Se estudiaron 128 pacientes de entre 18 y 70 años infectados con VIH desde junio del 2013 a junio de 2018 que concurrieron al Laboratorio de Análisis Clínicos del Hospital T. Schestakow de San Rafael Mendoza y al Laboratorio de Análisis de ADN de la Facultad de Ciencias Médicas de la Universidad Nacional de Cuyo. En todos los casos, los pacientes estaban bajo tratamiento antirretroviral y 7 de ellos, ya eran tratados con Abacavir previo al análisis de HLA-B*57:01. Se solicitó la firma del consentimiento informado y se tomaron muestras de sangre o hisopados bucales a partir de las cuales se extrajo ADN mediante métodos de Salting out o solventes orgánicos-Proteinasa K, respectivamente.
La tipificación del alelo HLA B*57:01 se realizó en el Laboratorio de Análisis de ADN de la Facultad de Ciencias Médicas de la UNCuyo mediante una reacción en cadena de la Polimerasa en tiempo real (PCR Real Time). Este método tiene como ventajas su simplicidad, rapidez, reducida manipulación de la muestra y bajo costo, pudiendo obtener resultados en el día con alta sensibilidad y especificidad. (Figura 4)
Figura 4. Gráfico de curvas de melting y diferenciación de muestras positivas y negativas para el HLA-B*57:01.
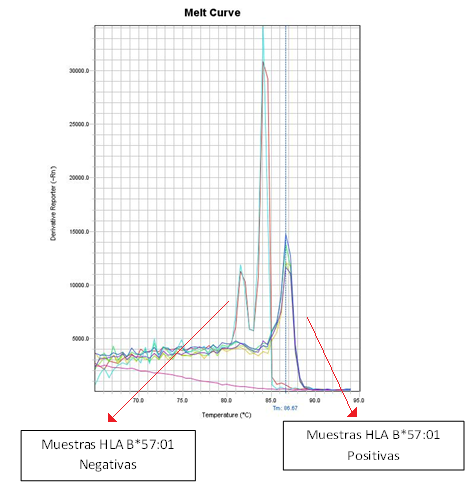
Fuente: Elaborado por las autoras
En la población estudiada se detectaron 6 pacientes positivos para el alelo HLA-B*57:01 (4,7%). Este resultado fue similar a los reportados en estudios realizados a nivel nacional (4,8%); Chile (3,7%); Brasil (3,1%) y otras poblaciones de origen caucásico-europeas. (Figura 5)
Figura 5. Prevalencia del alelo HLA-B ⃰ 57:01 en diferentes poblaciones del mundo
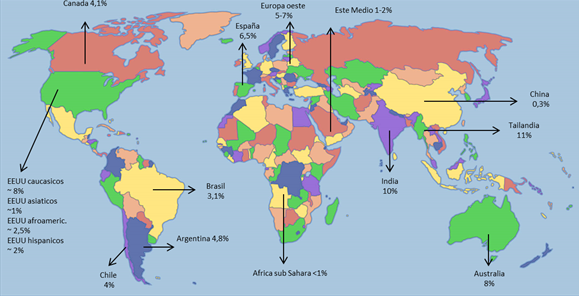
Fuente: Elaborado por las autoras
La identificación del alelo HLA-B*57:01 en 6 de los pacientes VIH+ permitió evitar la administración de Abacavir y personalizar los tratamientos antirretrovirales, disminuyendo así las posibles reacciones de hipersensibilidad y los costos asociados al tratamiento de dichas reacciones.
La prevalencia del alelo HLA-B*57:01 en Mendoza se corresponde con la hallada en otros estudios de Argentina y otros países latinoamericanos y europeos con un componente étnico mayormente de origen caucásico. Este resultado demuestra la importancia de realizar el estudio farmacogenético de tipificación HLA-B*57:01 en esta población según las recomendaciones establecidas para el tratamiento con Abacavir en poblaciones caucásicas.
La técnica de PCR Real Time con detección por curva de melting demostró ser una metodología rápida y directa para detectar el alelo HLA-B*57:01. Su aplicación permitirá acelerar los tiempos de tratamiento y seleccionar el esquema de medicamentos, eliminando así el componente empírico de las terapias antirretrovirales con Abacavir.
Segun las recomendaciones del consenso GESIDA (2011) las pautas recomendadas a seguir son las siguientes:
-Se debe determinar el HLA B*57:01 a todos los pacientes en el momento del diagnóstico o cuando vayan a comenzar tratamiento antirretroviral con Abacavir.
-Si el HLA B*57:01 es positivo no se debe prescribir Abacavir.
-Si el HLA B*57:01 es negativo no se puede descartar completamente la RHS, por lo que se debe informar al paciente y vigilar su posible aparición.
-Si se prescribe Abacavir sin conocer el resultado de HLA B*57:01 se debe informar al paciente y estar alerta para detectar síntomas de RHS.
Los resultados obtenidos en el presente trabajo describen la primera genotipificación del alelo HLA-B*57:01 en personas viviendo con VIH realizada en Mendoza.
Mendoza cuenta con el Programa Provincial de Sida desde el año 1997 que promueve la salud, previene la infección por VIH y asiste a las personas afectadas. Sus objetivos son establecer políticas preventivas y asistenciales en relación a la infección por VIH, garantizar la ejecución de estas políticas y reducir la morbilidad y mortalidad asociadas con la infección por VIH. Disponer del análisis de HLA-B*57:01 para los pacientes atendidos por dicho Programa o por centros médicos privados permitirá una mejor selección de tratamientos con disminución de reacciones adversas de hipersensibliidad. Esto implica un descenso de gastos médicos por internación y tratamientos de estas reacciones y una selección personalizada de medicamentos antirretrovirales para cada paciente.
Bibliografía
Afani AS, Gallardo AM. Antiretroviral resistance in human immunodeficiency virus infection Rev Chil Infect 2011; 28 (5): 461-469
Alfirevic A, Park B, Pirmohamed M, Naisbitt D. Reseach Highlights: Explanation for HLA-B*57:01 linked immune-mediated abacavir-induced hypersensivility. Pharmacogenomics (2012) 13(14), 1567–1569 ISSN 1462-2416.
Crovella S, Biller L, Santos S, Salustiano A, Brandao L, Guimaraes R, et al. Frequency of HLA B*5701 allele carriers in abacavir treated-HIV infected patients and controls from northeastern Brazil. Clinics (Sao Paulo). 2011; 66(8): 1485-1488.
Deepak, et al. Real-Time PCR: Revolutionizing Detection and Expression Analysis of Genes. Curr Genomics 2007 Jun; 8(4): 234–251.
Fainboim L., Geffner J. Introducción a la Inmunología Humana. 6ta ed. 2011
Guo Yong Li, Shi LeMing, Hong Hui Xiao, Su Zhen Qiang, Fuscoe James, Ning Bai Tang. Studies on abacavir-induced hypersensitivity reaction: a successful example of translation of pharmacogenetics to personalized medicine. Science China Life Sciences 2013.Vol.56 No.2: 119–124 doi: 10.1007/s11427-013-4438-8.
Hammond E., Mamotte C., Nolan D., Mallal. S. HLAB*57:01 typing: evaluation of an allele-specific polymerase chain reaction melting assay. Tissue Antigens. 2007 Jul; 70(1):58-61
http://allelefrequencies.net
Illing PT, Vivian JP, Dudek NL et al. Immune self-reactivity triggered by drug-modified HLA-peptide repertoire. Nature 2012; 486(7404), 554–558.
Kubista, et al. The real-time polymerase chain reaction. Mol Aspects Med. 2006 Apr-Jun; 27(2-3):95-125.
Mallal S, Phillips E, Carosi G, Molina JM, Workman C et al for th PREDICT-1 Study Team. HLA-B*57:01 Screening for hypersensitivity to Abacavir. N Engl J Med 2008;358: 568-79.
Mallal S, Phillips E, Carosi G, Molina JM, Workman C, Tomazic J, et al. HLAB*57:01 Screening for Hypersensitivity to Abacavir. N. Engl. J. Med. 2008; 358(6):568-579.
Martin A, Nolan D, Mallal S. HLA-B*5701 typing by sequence-specific amplification: validation and comparison with sequence-based typing. Tissue Antigens 2005; 65:571- 576.
Moragas M, Gurevich Messina JM, Aulicino P, Mecikovsky D, Bologna R, Bissio E, Falistoco C, Sen L, Mangano A. Implementación del estudio farmacogenético de hipersensibilidad al abacavir HLA-B*5701 en Argentina. Actualizaciones en Sida e infectología. Buenos Aires. Abril 2014. Volumen 22. Número 83:5-9.
Norcross MA, Luo S, Lu L. et al. Abacavir induces loading of novel self-peptides into HLA-B*57:01: an autoinmune model for HLA-associated drug hypersensivility. AIDS, 2012 Jul 17; 26(11):F21-9 doi: 10.1097/QAD.0b013e328355fe8f.
Ostrov DA, Grant BJ, Pompeu YA et al. Drug hypersensitivity caused by alteration of the MHC-presented self-peptide repertoire. Proc. Natl Acad. Sci. USA 109(25), 9959–9964 (2012).
Panel de expertos Gesida y Plan Nacional Sida. Documento de consenso de GESIDA/ Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (actualización enero 2011). Enferm Infecc Microbiol Clin. 2011;29(3):209.e1–209.e103
Pérez Prior N, Rocher Milla A, Soler Company E, Flores Cid J, Sarria Chust B. Correlación, en pacientes infectados por el VIH y previamente tratados, entre la reacción de hipersensibilidad a Abacavir y el alelo HLA-B*5701. Farmacia Hospitalaria. Valencia, España. 2009; 33 (3): 155-60.
Peters S, Muñoz M, Yerly S, et al. Resistence to nucleoside analogue reverse transcriptase inhibitors mediated by HIV-1 p6 protein. J Virol 2001; 75:9644-53.
Poggi H., Vera A., Lagos M., Solari S., Rodríguez L., Pérez C. HLA-B*5701 frequency in Chilean HIV-infected patients and in general population. Braz J Infect Dis 2010; 14(5):510-512.
Rodriguez-Nóvoa S, García-Gascó P, Blanco F, González-Pardó G, Castellares C, Moreno V, Jiménez-Nácher I, González-Lahoz J, Soriano V. Value of the HLA-B *5701 Allele to Predict Abacavir Hypersensitivity in Spaniards. AIDS research and human retroviruses. 2007; Volume 23, 1374-1376.
Stocchi L, Cascella R, Zampatti S, Pirazzoli A, Novelli G, Giardina E. The Pharmacogenomic HLA Biomarker Associated to Adverse Abacavir Reactions: Comparative Analysis of Different Genotyping Methods. Curr Genomics. 2012 Jun; 13(4):314-20.doi: 10.2174/138920212800793311.
www.hla.allele.org
Link permanente:
http://www.politicaspublicas.uncu.edu.ar/articulos/index/seguridad-en-el-tratamiento-de-pacientes-vih-analisis-farmacogenetico-de-hla-b5701-
Advertencia legal:
Las opiniones y los conceptos vertidos en los artículos publicados expresan la postura de sus respectivos autores y no necesariamente coinciden con la de la Universidad Nacional de Cuyo. La institución declina toda responsabilidad por las consecuencias que pudieran derivarse de la lectura y/o interpretación del contenido de los artículos publicados.
 Esta obra está licenciada bajo una Licencia Creative Commons Attribution-NonCommercial-ShareAlike 2.5 Argentina .
Esta obra está licenciada bajo una Licencia Creative Commons Attribution-NonCommercial-ShareAlike 2.5 Argentina .





Compartir